Sabes, ¿Qué es electrólisis?

La electrólisis es el proceso en el que los elementos de un compuesto se separan mediante la aplicación de electricidad, dicho de otro modo, la energía eléctrica se transforma en energía química. El proceso químico denominado electrólisis ha adquirido mucho protagonismo en los últimos años, ya que es clave en el proceso de producción de hidrógeno verde, sin embargo, no es una novedad, esta lleva utilizándose durante décadas en otras muchas aplicaciones.
Para que se produzca el proceso electroquímico denominado electrólisis, son necesarios dos elementos, además de la corriente eléctrica que hará posible la reacción química no espontánea: los electrodos y el electrolito. El electrolito es una solución acuosa o salina en la que se sumergen los electrodos (ánodo y cátodo), el conjunto de todos estos elementos se denomina célula de electrólisis. El electrolito permite la transferencia de iones entre el ánodo y el cátodo al aplicarse una corriente eléctrica.
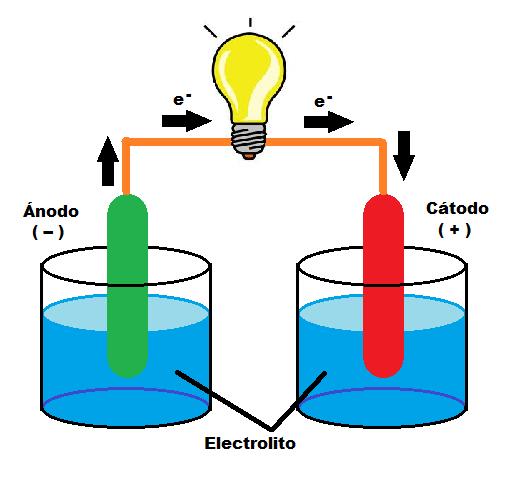
¿Cómo funciona la electrólisis? El electrolito se funde o disuelve en un disolvente para que se produzca la separación de los iones, proceso denominado ionización. A continuación, se aplica una corriente eléctrica continua a través de los electrodos (ánodo y cátodo) sumergidos en la disolución y que están conectados a una fuente de alimentación. Se produce la transferencia de electrones, los iones positivos o cationes van al cátodo y los iones negativos o aniones van al ánodo.
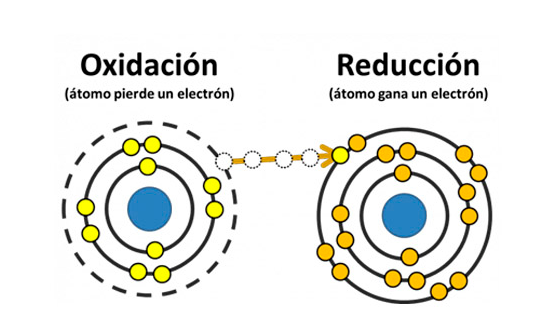
A consecuencia de esta reacción química, se producen otras sustancias, los aniones ceden electrones al ánodo (+) y los cationes toman electrones del cátodo (-). De esta forma se completa la reacción de oxidación-reducción a través de la aportación de electricidad como fuente de energía necesaria para ello. Tras completarse el proceso, se desprenden oxígeno e hidrógeno, así como otros materiales si se ha utilizado agua no destilada.
Algunos aspectos importantes a tener en cuenta a la hora de realizar el proceso de electrólisis es que los electrodos nunca deben entrar en contacto directo, pues en ese caso del proceso no se completa y la batería se sobrecalentará y quemará. Además, la corriente eléctrica aplicada debe ser siempre continua, es decir, nunca a través de un enchufe, sino de una batería o adaptador de corriente y finalmente, es importante que los gases desprendidos (oxígeno e hidrógeno) no se contacten entre sí, pues de lo contrario volverían a producir agua.
El proceso de electrólisis se utiliza para producir hidrógeno verde, como también en las baterías, incluidas las de los coches eléctricos, además se utiliza en la producción de materiales y compuestos químicos como aluminio, sodio, ácido clorhídrico o hipoclorito (lejía), entre muchos otros. Da paso a la electrometalurgia que es un proceso para separar metal puro de otros compuestos, también es utilizado para el método de anodización que sirve para incrementar el espesor de la capa natural de óxido en la superficie de piezas metálicas y funciona para realizar galvanoplastia que es la creación de una película protectora para proteger un metal de la corrosión.
Realicemos la siguiente práctica y veamos cómo funciona la electrólisis



Responses